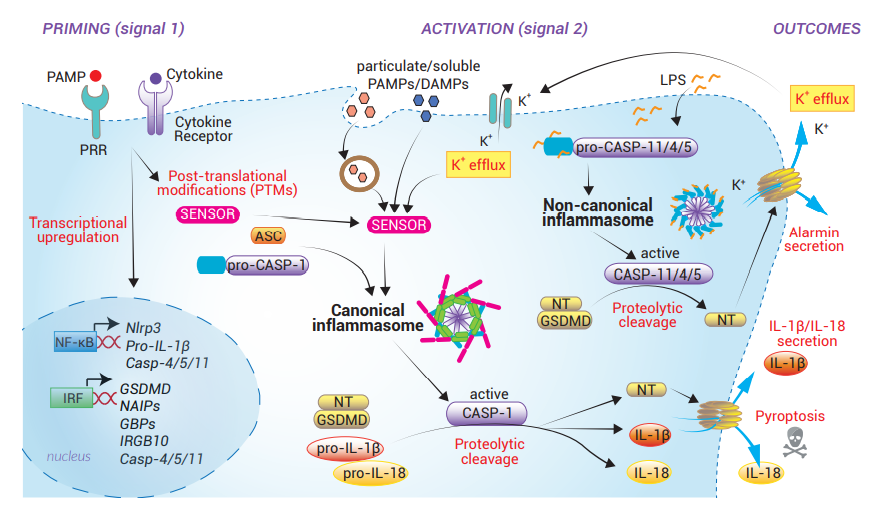
炎症小体是由细胞内的传感器和连接着接头蛋白的炎性caspase共同组成的多蛋白复合物。它们的组装可以由多种微生物和宿主源性刺激物触发。一旦炎症小体被激活,它们就会在细胞表面形成Gasdermin-D膜孔,允许非经典分泌IL-1β和IL-18促炎细胞因子、IL-1α和HMGB1警报素蛋白,最终导致细胞焦亡。当炎症小体的组装需要caspase-1时,它们属于“经典”的炎症小体;当炎症小体的组装依赖于人源caspase-4或caspase-5(或它们的小鼠同源蛋白caspase-11)时,则为“非经典”的炎症小体。
炎症小体传感器
炎症小体是根据其传感器命名。这些传感器主要是以蛋白质结构域分类的细胞质模式识别受体(PRRs)。大多数PRRs都是属于NLR(核苷酸结合域(NBD)和富含亮氨酸重复序列(LRR)受体)家族,特别是NLRP和NLRC亚群。NLRPs与NLRCs的差异在于其N-末端的pyrin结构域(PYD)和 caspase募集结构域(CARD)。NLR传感器包括NLRP3、NLRP1和NLRC4能够形成炎症小体。其他非NLR传感器也可以形成炎症小体,如AIM2和Pyrin。不论是否有ASC接头蛋白,这些传感器可以通过招募caspase-1(CASP-1)引发经典炎症小体的组装。至于非经典炎症小体的组装涉及同时具有传感器和效应蛋白功能的人源CASP-4/5或鼠源CASP-11。
经典炎症小体传感器
NLRP3(又名cryopyrin或NALP3)是自Tschopp团队在2004年发现其炎症小体组装功能以来最为广泛研究的传感器 [1]。这种LRR�NOD-PYD传感器可被多种结构和化学上不相关的刺激物激活(如造孔毒素、离子通道激活剂、尿酸晶体、β-淀粉样蛋白)[2-4],显示出NLRP3不会直接与这些分子结合。NLRP3反而感测下游细胞应激信号,例如离子失衡,尤其感测可能造成细胞内稳态絮乱的K+外排 [5]。重要的是,NLRP3参与多种疾病的炎症病理过程,包括阿尔茨海默病、2型糖尿病和COVID-19(咨询欣博盛生物获取更详细资料)。
NLRC4(又名Ipaf)是在2004年首次被Dixit团队报道其引发炎症反应的作用 [6]。后来,Vance和Shao团队更证实NLRC4是一种间接传感器,与NLR家族凋亡抑制蛋白(NAIPs)有相互作用。NLRC4可以直接与细胞内的细菌(如鞭毛蛋白)和细菌分泌系统的组成部分(如内杆和针型蛋白)产生的PAMPs结合。虽然人源NLRC4的上游只有一种NAIP蛋白去识别这些PAMPs的激活分子 [7],但研究显示,小鼠拥有多个NAIPs基因,不同的NAIPs蛋白在识别不同PAMPs分子有偏好性 [8-11]。此外,NLRC4炎症小体亦表现出可以保护肺部、胃部和肠道中的粘膜屏障免受细菌入侵 [12]。
NLRP1(又名NALP1)是NLR家族第一个被发现的炎症小体传感器,在2001-2002年被Tschopp团队描述了其特征 [13, 14]。人源NLRP1具有一个CARD和一个PYD结构域;而鼠源NLRP1的旁系同源基因(a,b,c)则欠缺了PYD结构域,这些同源基因当中尤其以NLRP1b最为研究透彻。另外,人源和鼠源NLRP1都有一个位于CARD上游的独特FIIND(function to find domain)结构域。尽管目前仍然没有辨别出NLRP1的同源配体 [15, 16],但已知的是NLRP1b的活化由致病酶(例如炭疽杆菌致死因子或弗氏志贺菌IpaH7.8)所诱导,这些致病酶会触发FIIND结构域的自切割和N末端结构域的蛋白酶体降解 [16]。
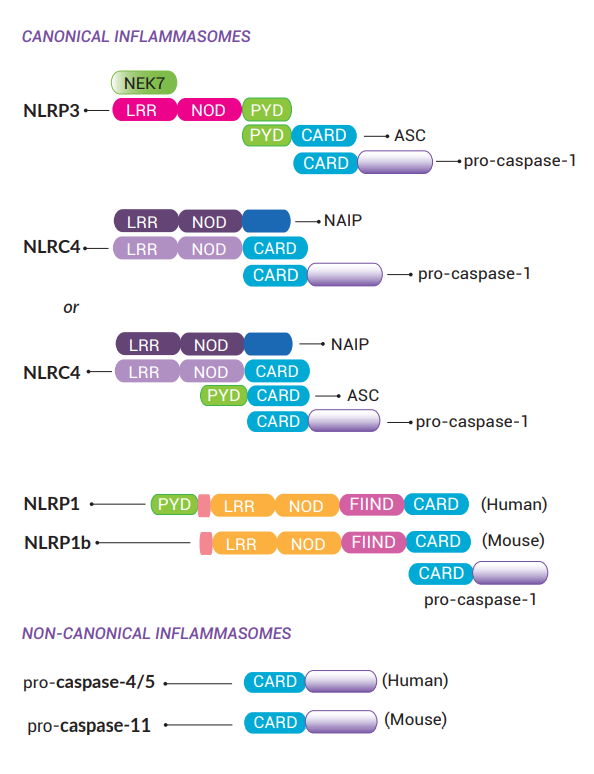
AIM2(黑色素缺乏因子2)是一种含有PYD结构域和寡核苷酸结合结构域的非NLR蛋白。AIM2是微生物或宿主来源(细胞损伤后)的细胞质双链DNA(dsDNA)的受体,其识别不依赖特定的DNA序列顺序,但依赖于序列的长度 [17-19]。虽然有研究证实AIM2在鼠源骨髓细胞中形成炎症小体的功能,但在人源细胞的形成机制则尚未明确 [19-21]。
Pyrin最初是在携带MEFV基因突变的家族性地中海热(FMF)患者中发现。现时除了知道它的激活涉及其PYD结构域外,还未完全清楚它的激活机制。此外,尽管它已被证明能感应细胞骨架动态的异常变化,并能被Rho修饰蛋白(例如艰难梭菌毒素B和肉毒梭菌毒素C3)激活 [15],但它的同源配体仍然不明。
NLRP6 和 NLRP9b 传感器越来越受到关注,有数个研究显示它们介导了小鼠的炎症反应,尤其是在肠上皮细胞中的炎症反应 [15]。
非经典传感器
人源caspase-4和caspase-5(CASP-4/5)和鼠源caspase-11(CASP-11)拥有双重功能。它们既是细胞溶质脂多糖(LPS)直接的受体,也是炎症小体直接的效应蛋白。更确切地说,CASP-11/4/5形成非经典炎症小体,导致CASP-1依赖性的IL-1β和IL-18分泌,以及CASP-1非依赖性的细胞死亡 [22, 23]。
知识点:“经典”和“非经典”的术语不仅指炎症小体的类型,还指导致炎症小体激活的途径类型。NLRP3和CASP-11分别形成经典和非经典炎症小体。然而,NLRP3均可以通过经典和非经典途径活化,详情请咨询欣博盛生物,获取更详细的资料。
接头蛋白
ASC(凋亡相关斑点样蛋白)又名PYCARD,是由CARD和PYD结构域两部分组成的接头蛋白,允许传感器和pro-caspase-1之间的相互作用。这个蛋白是由不含CARD结构域的炎症小体传感器(如NLRP3和AIM2)所招募的。而NLRP1、NLRC4和CASP-11/4/5炎症小体的形成过程并不需要ASC [15, 23]。在静止细胞中,ASC作为可溶蛋白分散存在于细胞质和细胞核。当炎症小体被激活后,ASC分子会在每个细胞中聚集形成一个微米级的“斑点”,从而集中CASP-1的激活位点 [24]。
NEK7(NIMA相关蛋白激酶7)是一种与有丝分裂相关的丝氨酸�苏氨酸激酶,最近被发现其为NLRP3炎症小体活化的必需蛋白,且作用于K+外排的下游。经体内和体外使用NLRP3激动剂刺激验证,NEK7的缺失会阻断CASP-1的激活和IL-1β的释放 [25]。有研究显示,NEK7通过结合LRR结构域,桥接相邻的NLRP3分子,从而发挥其支架功能 [26]。
效应蛋白
Caspase-1(CASP-1)是一种半胱氨酸蛋白酶,最初被命名为白细胞介素-1β-转换酶(ICE)[27]。CASP-1由无活性的caspase-1前体(pro-caspase-1)生成,包含N端CARD结构域和两个催化亚基p20和p10。CASP-1通过其CARD结构域被招募到经典炎症小体。有研究显示,四聚体形式的CASP-1(以及CASP-4或-11)允许邻近诱导的自溶激活,释放p20和p10亚基 [28]。活化的CASP-1能够将pro-IL-1β和pro-IL-18细胞因子以及Gasdermin D切割为它们具生物活性的形态。目前还需要进行更多的结构研究去了解其确切的作用方式。
Gasdermin D(GSDMD)又名DFNA5L或FKSG10,于2004年首次被发现,但近10年来仍未清楚其生物学功能。这种细胞质蛋白含有两个被连接区域分隔的结构域,而C端结构域(GSDMD-CT)会抑制着N端结构域(GSDMD-NT)。活化的CASP-1或CASP-11/4/5会切割它们中间的连接区域,释放GSDMD-NT片段。GSDMD-NT其后与膜脂质结合,导致其寡聚化并在细胞膜上形成内径约为18 nm的孔 [30]。成熟的IL-1β、IL-18和警报素继而通过GSDMD孔分泌出来,最终GSDMD孔的积累会引致细胞焦亡。
白细胞介素(IL)-1β和IL-18是在许多炎症的激活和调节事件上起重要作用的细胞因子。IL-1β诱导包括发热、血管扩张、遭受感染或组织损伤后的免疫细胞浸润等的基因表达控制。IL-18除了是诱导干扰素-γ(IFN-γ)产生所必需的细胞因子外,也负责介导适应性免疫应答的共刺激性细胞因子。这两种细胞因子必须通过切割其pro-IL-1β和pro-IL-18的酶原前体才能产成成熟的形态 [31]。由于它们缺乏进入囊泡介导的生物合成途径所必需的N端信号序列,这些细胞因子会从非经典途径(即通过GSDMD孔)分泌。
警报素(Alarmins)是受损或死亡的细胞对感染或损伤作出反应时所释放的DAMPs。这些分子在体内稳态时以低水平存在于细胞质中,并随时准备在炎症小体应答时分泌。当它们的表达被上调,危险信号得以传播出去。其中IL-1α [32]和HMGB1(高迁移率族蛋白-1)[33]被认为是炎症小体激活时释放的两种主要警报素蛋白。
更多技术资料或相关产品详情请咨询Invivogen中国一级代理商-欣博盛生物
参考资料
1. Agostini, L., et al., Immunity, 2004. 20(3): p. 319-325.
2. Mariathasan, S., et al., Nature, 2006. 440(7081): p. 228-232.
3. Martinon, F., et al., Nature, 2006. 440(7081): p. 237-241.
4. Kanneganti, T.-D., et al., Nature, 2006. 440(7081): p. 233-236.
5. Swanson, K.V., M. Deng, and J.P.Y. Ting, Nature Reviews Immunology, 2019.
6. Mariathasan, S., et al., Nature, 2004. 430(6996): p. 213-218.
7. Yang, J., et al., Proceedings of the National Academy of Sciences, 2013. 110(35): p. 14408-14413.
8. Kofoed, E.M. and R.E. Vance, Nature, 2011. 477(7366): p. 592-595.
9. Zhao, Y., et al., Nature, 2011. 477(7366): p. 596-600.
10. Rauch, I., et al., Journal of Experimental Medicine, 2016. 213(5): p. 657-665.
11. Zhao, Y., et al., Journal of Experimental Medicine, 2016. 213(5): p. 647-656.
12. Bauer, R. and I. Rauch, Molecular Aspects of Medicine, 2020(76): p. 100863.
13. Martinon, F., K. Hofmann, and J. Tschopp, Current Biology, 2001. 11(4): p. R118-R120.
14. Martinon, F., K. Burns, and J. Tschopp, Molecular Cell, 2002. 10(2): p. 417-426.
15. Xue, Y., et al., Trends in Immunology, 2019. 40(11): p. 1035-1052.
16. Taabazuing, C.Y., A.R. Griswold, and D.A. Bachovchin, Immunological Reviews, 2020. 297(1): p. 13-25.
17. Hornung, V., et al., Nature, 2009. 458: p. 514.
18. Fernandes-Alnemri, T., et al., Nature, 2009. 458(7237): p. 509-513.
19. Hayward, J.A., et al., Microbiology and Molecular Biology Reviews, 2018. 82(4): p. e00015-18.
20. Jones, J.W., et al., Proceedings of the National Academy of Sciences, 2010. 107(21): p. 9771-9776.
21. Gaidt, M.M., et al., Cell, 2017. 171(5): p. 1110-1124.e18.
22. Kayagaki, N., et al., Nature, 2011. 479(7371): p. 117-121.
23. Shi, J., et al., Nature, 2014. 514: p. 187.
24. Hoss, F., J.F. Rodriguez-Alcazar, and E. Latz, Cellular and Molecular Life Sciences, 2017. 74(7): p. 1211-1229.
25. He, Y., et al., Nature, 2016. 530: p. 354.
26. Sharif, H., et al., Nature, 2019. 570(7761): p. 338-343.
27. Thornberry, N.A., et al., Nature, 1992. 356(6372): p. 768-774.
28. Shi, J., et al., Nature, 2015. 526: p. 660.
29. Man, S.M. and T.-D. Kanneganti, Nature Reviews Immunology, 2015. 16(1): p. 7-21.
30. Ding, J., et al., Nature, 2016. 535(7610): p. 111-116.
31. Dinarello, C.A., Immunological Reviews, 2018. 281(1): p. 8-27.
32. Di Paolo, N.C. and D.M. Shayakhmetov, Nature Immunology, 2016. 17(8): p. 906-913.
33. Kang, R., et al., Molecular Aspects of Medicine, 2014. 40: p. 1-116.