StressMarq Biosciences 开发了一系列用于神经退行性疾病研究的单体、原纤维和寡聚体蛋白制剂,包括 α 突触核蛋白、β 突触核蛋白、γ 突触核蛋白、tau、β 淀粉样蛋白、SOD1 和 TTR。我们的目标是成为开发和供应活性病理诱导蛋白聚集体的世界领先制造商,以帮助科学家开发疾病模型并加速神经退行性疾病药物的研发。
Alpha 突触核蛋白单体, 寡聚体和前体原纤维 (PFFs)
Alpha Synuclein 是一种易溶的小分子蛋白质,没有内在结构,大量存在于大脑中,主要存在于神经元的突触前末端。它参与突触小泡释放信号物质的过程,其中包括对运动很重要的多巴胺。 α-突触核蛋白已被证明可以聚合成各种寡聚体和纤维形式,可溶的、错误折叠的 α-突触核蛋白聚集体具有神经毒性,并且可以以朊病毒样方式传播疾病。 “突触核蛋白病”是一类神经退行性疾病,包括帕金森病 (PD)、路易体痴呆 (DLB)、弥漫性路易体病 (DLBD) 和多系统萎缩 (MSA),这些疾病都是由错误折叠的 α 突触核蛋白引起的。事实上,α-突触核蛋白聚集是帕金森病的标志,不同形式的蛋白质可用于开发重现这种疾病病理特征的疾病模型。StressMarq提供用于神经退行性疾病研究的 α 突触核蛋白单体,寡聚体和原纤维等各种形态的构建体。这些制剂具有不同的特性和性质。请观看我们的视频,了解我们的 α 突触核蛋白产品如何帮助科研学者开发疾病模型和测试候选药物。
单体
StressMarq的 alpha 突触核蛋白单体可以聚集但是没有展现出神经毒性。
| 产品描述 | 目录号 |
| 人 Alpha 突触核蛋白单体 (1型) | SPR-321 |
| 人 Alpha 突触核蛋白单体 (2型) | SPR-316 |
| 小鼠 Alpha 突触核蛋白单体 (1型) | SPR-323 |
| 人 Alpha 突触核蛋白 A53T 突变型单体 (1型) | SPR-325 |
| 人氨基末端乙酰化的Alpha 突触核蛋白单体 (1型) | SPR-331 |
| 大鼠 Alpha 突触核蛋白单体 | SPR-481 |
寡聚体
α 突触核蛋白寡聚体越来越多地被认为是突触核蛋白病中的最具毒性的物质。 StressMarq 的动态学稳定的 α 突触核蛋白寡聚体是在不添加任何诱导剂或抑制剂的情况下生产的,对多巴胺能神经元具有毒性,并可诱导 α 突触核蛋白 Ser129 的磷酸化(与帕金森病相关的病理学特征)。 StressMarq 还提供多巴胺稳定的 α 突触核蛋白寡聚体和 EGCG 稳定的 α 突触核蛋白寡聚体。多巴胺和 EGCG 可用于稳定寡聚体形式的 α-突触核蛋白,防止其进一步聚集成原纤维。
| 产品描述 | 目录号 | 单体来源 |
| 人 Alpha 突触核蛋白寡聚体 (动态学稳定的) | SPR-484 | 人 Alpha 突触核蛋白单体 (2型), 目录号 SPR-316 |
| 人 Alpha 突触核蛋白寡聚体 (盐酸多巴胺稳定的) | SPR-466 | 人 Alpha 突触核蛋白单体 (2型), 目录号 SPR-316 |
| 人 Alpha 突触核蛋白寡聚体 (EGCG 稳定的) | SPR-469 | 人 Alpha 突触核蛋白单体 (2型), 目录号 SPR-316 |
前体原纤维 (PFFs)
StressMarq 的 alpha 突触核蛋白前体原纤维 (PFFs) 可以聚集alpha 突触核蛋白活性单体形成新的原纤维, 并且可以用于诱导内源性alpha突触核蛋白的磷酸化和神经元中路易体的形成,以及体外寡聚化研究。
| 产品描述 | 目录号 | 单体来源 |
| 人 Alpha 突触核蛋白前体原纤维 (1型) | SPR-322 | 人 Alpha 突触核蛋白单体, 目录号 SPR-321 |
| 人 Alpha 突触核蛋白前体原纤维 (ATTO 594 标记的, 1型) | SPR-322-A594 | 人 Alpha 突触核蛋白单体, 目录号 SPR-321 |
| 小鼠 Alpha 突触核蛋白前体原纤维 (1型) | SPR-324 | 小鼠 Alpha 突触核蛋白单体, 目录号 SPR-323 |
| 人 Alpha 突触核蛋白前体原纤维 (2型) | SPR-317 | 人 Alpha 突触核蛋白单体 (2型), 目录号 SPR-316 |
| 人氨基末端乙酰化的 Alpha 突触核蛋白前体原纤维 (1型) | SPR-332 | 人氨基末端乙酰化的 Alpha 突触核蛋白单体, 目录号 SPR-331 |
| 人 Alpha 突触核蛋白 A53T 突变型前体原纤维 (1型) | SPR-326 | 人 A53T Alpha 突触核蛋白单体 (1型), 目录号 SPR-325 |
| 大鼠 Alpha 突触核蛋白前体原纤维 | SPR-482 | 大鼠 Alpha 突触核蛋白单体, 目录号 SPR-481 |
| 人 Alpha 突触核蛋白前体原纤维 (3型) | SPR-448 | 人 Alpha 突触核蛋白单体 (2型), 目录号 SPR-316 |
| 人 Alpha 突触核蛋白纤丝 (未成熟的原纤维) | SPR-450 | 人 Alpha 突触核蛋白单体, 目录号 SPR-321 |
Alpha 突触核蛋白前体原纤维 (PFFs) 在细胞之间的传递
StressMarq 的 Alpha 突触核蛋白 PFFs 目录号 SPR-322 (下图 红色 显示的), 在14天内由 SH-SY5Y 细胞转移到了神经元 iPSCs 中。
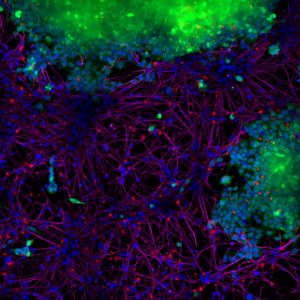 |
| 蓝色: Hoechst/DNA | 绿色: SHSY5Y-GFP | 红色: StressMarq的 α-syn PFFs-555 | 紫色: Tubulin |
Alpha 突触核蛋白单体,寡聚体和前体原纤维(PFFs)的二级结构
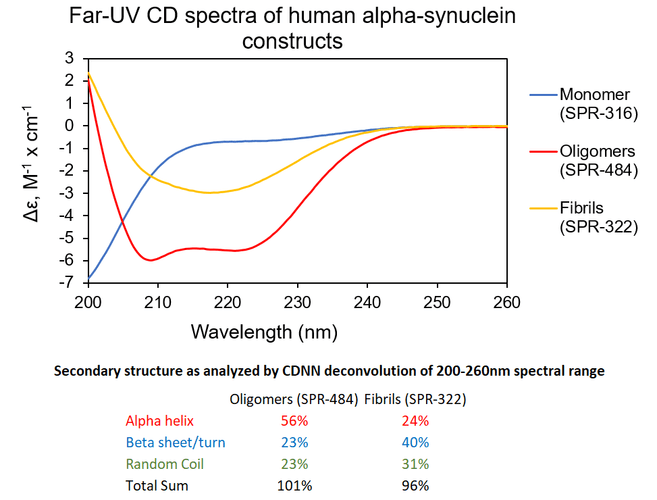
寡聚体 & 原纤维. UV-CD 数据显示 StressMarq的 Alpha 突触核蛋白寡聚体有特别的不同于单体和原纤维的二级结构。具体一点说, 我们的动态学稳定的 Alpha 突触核蛋白寡聚体 (目录号 SPR-484) 显示出比Alpha 突触核蛋白前体原纤维(Type 1) (目录号 SPR-322) 明显更高的 alpha 螺旋含量和更低的beta折叠含量。Alpha 突触核蛋白单体 (目录号 SPR-316) 在 200 nm处显示出很强的负信号,表明蛋白处于无序结构状态 (缺乏二级结构).
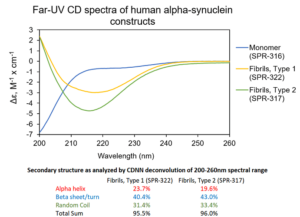
1 型 & 2 型前体原纤维. UV-CD 数据显示 StressMarq 的 Alpha 突触核蛋白前体原纤维 (PFFs), 1 型 (目录号SPR-322) 和 2 型 (目录号 SPR-317) 都含有 较高的 beta 折叠,但是二级结构确实有轻微差别。Alpha 突触核蛋白单体 (目录号 SPR-316) 在 200 nm处显示出很强的负信号,表明蛋白处于无序结构状态 (缺乏二级结构). 在这个实验中, 前体原纤维 (PFFs) 进行了 10 个循环的超声处理以确保测量之前的可溶性。
动态学稳定的 Alpha 突触核蛋白寡聚体诱发毒性和病理学现象
动态学稳定的 alpha 突触核蛋白寡聚体 (目录号 SPR-484) 对多巴胺能神经元有毒性并且能诱发alpha 突触核蛋白 Ser129 号位的磷酸化, 这是帕金森疾病的标志性病理现象。该寡聚体在一次冻融以后或者37摄氏度孵育两周后依然稳定。
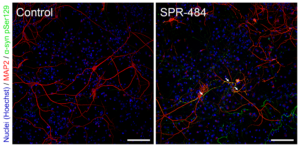 | 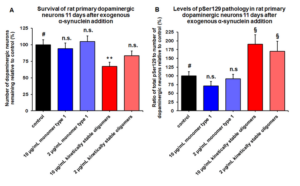 | 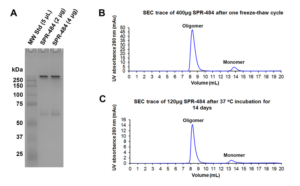 |
| 动态学稳定的alpha突触核蛋白寡聚体 (目录号 SPR-484)。在原代大鼠多巴胺能细胞中诱发帕金森相关的 pSer129 病理现象。 | 动态学稳定的 alpha 突触核蛋白寡聚体 (目录号 SPR-484) 显示出对原代大鼠多巴胺能神经元的毒性。 | 动态学稳定的 alpha 突触核蛋白寡聚体 (目录号 SPR-484) 在一次冻融以后或者37摄氏度孵育两周后依然稳定. |
StressMarq Alpha 突触核蛋白产品的引用发表文献
人 Alpha 突触核蛋白 (1 型), 目录号 SPR-322
1.Deciphering the role of hsp110 chaperones in diseases of protein misfolding. Yakubu, U. M. (2021) PhD Thesis, University of Texas.
2.Suppression of aggregate and amyloid formation by a novel intrinsically disordered region in metazoan Hsp110 chaperones. Yakubu, U.M., Morano, K.A. (2021) J Biol Chem Jan-Jun 2021;296:100567. Read a summary of this paper on our blog.
3.Design, Synthesis and Chemically Engineered Graphene Quantum Dot Applications: Contrast Agent for MR Imaging and Targeted Therapeutics on Parkinson’s Treatment. Poonkuzhali, K. et al. (2022) SSRN 4056733.
小鼠 Alpha 突触核蛋白前体原纤维 (1型), 目录号 SPR-324
1.The SUMO conjugase Ubc9 protects Dopaminergic cells from cytotoxicity and enhances the stability of α-synuclein in Parkinson’s disease models. Verma, D.K. et al. (2020) eNeuro 0134-20.2020. Read a summary of this paper on our blog.
2.Alpha-Synuclein Preformed Fibrils Induce Cellular Senescence in Parkinson’s Disease Models. Verma, D.K. et al. (2021) Cells 10, 1694.
3.Heat Shock Protein 70 as a Sex-Skewed Regulator of α-Synucleinopathy. (2021) Bhatia, T. N. et al. Neurotherapeutics Oct;18(4):2541-2564.
4.Domain-Independent Inhibition of CBP/p300 Attenuates α-Synuclein Aggregation. Hlushchuk, I. et al. (2021) ACS Chem. Neurosci. Jul 7;12(13):2273-2279.
人 Alpha 突触核蛋白 A53T 突变型前体原纤维 (1型), 目录号 SPR-326
1.Environmental enrichment reduced pathological α-Synuclein accumulation by restoring LAMP1 via Reelin in early stage of Parkinson’s disease. Cho, E. (2021) PhD Thesis, Yonsei University.
2.Reelin Alleviates Mesenchymal Stem Cell Senescence and Reduces Pathological α-Synuclein Expression in an In Vitro Model of Parkinson’s Disease. Cho, E. (2021) Genes 12, 1066.
人 Alpha 突触核蛋白前体原纤维 (2 型), 目录号 SPR-317
1.Directed Evolution of Antibodies Against Complex Targets. Desai, A. (2021) PhD Thesis, University of Michigan.
如需订购Stressmarq品牌产品,请联系一级代理商-欣博盛生物
全国服务热线: 4006-800-892 邮箱: market@neobioscience.com
深圳: 0755-26755892 北京: 010-88594029
上海: 021-34613729 广州: 020-87615159
代理品牌网站: www.neobioscience.com
自主品牌网站: www.neobioscience.net