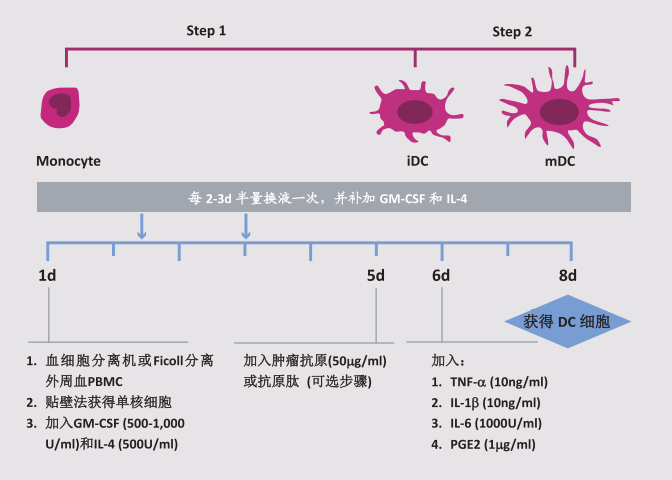
MoDC制备方法简图
背景
DC是“Dendritic Cells”的缩写,中文全称为“树突状细胞”,因其成熟时伸出许多树突样或伪足样突起而得名。DC 是由 2011 年诺贝尔奖获得者、加拿大籍科学家 Ralph M. Steinman 于1973 年发现的,是目前发现的功能最强的抗原递呈细胞 (Antigen Presenting Cells, APC) 。已证实,DC 是唯一能够显著刺激初始 T 细胞(Naïve T cells)增殖的APC,而其它种类的APC ( 如单核巨噬细胞,B 细胞等) 仅能刺激已活化的或记忆性的 T 细胞,因此 DC 是机体适应性 T 细胞免疫应答的始动者,在肿瘤免疫中发挥着极其重要的作用。
DC 培养原理
因为DC需从其它种类细胞诱导分化而来,且可分为不同的成熟阶段,所以通常分为2个步骤进行培养:
Step 1:从DC的祖细胞(如单核细胞) 诱导分化为未成熟DC(immature DC, iDC) ;
Step 2:从iDC诱导分化为成熟DC(mature DC, mDC) 。
Step 1:
GM-CSF(粒细胞巨噬细胞集落刺激因子)
GM-CSF是一种造血生长因子, 在体外可刺激中性粒细胞和巨噬细胞集落的形成,并具有促进早期红巨核细胞、嗜酸性祖细胞增殖和发育的功能。GM-CSF是最早被鉴定出对DC培养有作用的细胞因子之一。
GM-CSF在DC培养中的功能是促进单核细胞向大巨噬样细胞分化, 细胞表面MHCⅡ类分子的表达得以提高, 从而增强细胞的抗原递呈功能。此外, GM-CSF也有助于DC的存活。
IL-4(白细胞介素-4)
IL-4在由单核细胞诱导成DC的过程中可抑制巨噬细胞的过度生长,从而引导单核细胞向DC方向分化。若培养体系中不加IL-4,单核细胞将分化为巨噬细胞。同时、IL-4还有降低细胞表面表达CD14分子的能力。CD14表达水平的降低是单核细胞分化为DC的重要标志。
GM-CSF和IL-4共同作用可使单核细胞定向分化为未成熟DC, 此时的DC具有较强的抗原摄取和加工能力, 但抗原递呈能力很弱。细胞表面中度表达MHC I类、Ⅱ类分子和B7家族分子(CD80,CD86等),但不表达或低表达CD14。
Step 2:
TNF-a/IL-1β/IL-6(肿瘤坏死因子-a/白细胞介素-1β/白细胞介素-6)
TNF-a, IL-1β和IL-6均为促炎症因子, 在感染局部和肿瘤部位被诱导产生。体外研究表明,这3种细胞因子均可下调未成熟DC的巨胞饮作用和表面Fc受体的表达,使细胞内MHCⅡ类分子区室(class II compartment) 消失, 但能够上调细胞表面MHC I类、Ⅱ类分子和B7家族分子(CD80,CD86等)的表达,使未成熟DC分化为成熟DC,此时DC的抗原摄取和加工能力明显减弱,而抗原递呈能力显著增强,可极强地激活T细胞。
TNF-o/IL-1β/IL-6三因子组合可在无牛血清培养条件下诱导DC的完全成熟, 从而制备出可以应用于临床的DC。
·PGE 2(prostaglandin E 2, 前列腺素E 2)
PGE 2也是炎性介质, 可由TNF-a, IL-1和LPS(脂多糖) 等炎症信号诱导产生。在TNF-a/IL-1B/IL-6成熟诱导组合中添加PGE 2, 可进一步提高DC的产量、成熟度、迁移能力和免疫激活能力。
这里尤为重要的是DC迁移能力的提高。因为TNF-0/IL-1B/IL-6诱导成熟的DC迁移能力较弱, 不能很好地到达淋巴结而激活T细胞。而添加PGE 2后诱导成熟的DC因表面趋化因子受体的高表达,更容易迁移至淋巴结,从而引起机体对抗肿瘤的免疫反应。
因此, TNF-α/IL-1β/IL-6/PGE 2组合(见下表) 广泛应用于临床, 并被认为是制备成熟DC的“金标准”。
| 组份 | 工作浓度 |
| TNF-α | 10ng/ml |
| IL-1β | 10ng/ml |
| IL-6 | 1000U/ml |
| PGE 2 | 1ug/ml |
注意事项
1.DC的来源
DC有多种来源, 包括外周血单核细胞(Monocyte) 、脐带血CD 34*细胞、骨髓和胎肝等,但因外周血单核细胞最容易获取、数量也最多,所以临床上被广泛用作DC的来源细胞。
2.DC的成熟度:
我们知道, DC有未成熟和成熟两种状态, 即iDC和mDC, DC的抗原递呈能力 与其成熟状态密切相关。
iDC的抗原摄取和加工能力较强, 但抗原递呈能力很弱。在体外培养时, iDC去除细胞因子(即GM-CSF和IL-4) 后, 会逆转为巨噬细胞。且即使在细胞因子的维持下, 未成熟DC的功能也不是激活T细胞,而是抑制T细胞的增殖。
mDC则正好相反, 其抗原摄取和加工能力很弱, 但具有很强的抗原递呈能力。因而可以激活T细胞,引起免疫反应。而且DC成熟后即使在培养体系中去除细胞因子,仍能保持DC的状态和功能,不会发生逆转。
因此可以看出,DC必须完全成熟后才能用于免疫治疗。
3.DC的无牛血清培养:
DC最初都是在含有小牛血清(Fetal Calf Serum, FCS) 的培养体系中获得的, 但我们知道, 如果想将DC应用于临床治疗, 则不能使用FCS。然而如果不用FCS,DC则无法培养成功。
科学家最先想到的是用10%的人自体血浆来替代10%的FCS, 但实验结果表明, 人单核细胞在含10%人自体血浆的培养液中培养, 用GM-CSF和IL-4诱导7天后, 大多数单核细胞仍贴壁, 半悬浮的iDC数量非常少。后来经过不断摸索发现, 在无血清培养基中添加1%人自体血清对于从单核细胞诱导成为iDC效果最好。
更为困难的步骤是如何在无牛血清培养体系中将iDC诱导成为mDC。
TNFα-和IL-1β在含牛血清培养体系中均是很好的DC成熟诱导剂, 而在无牛血清培养体系中, 两者均无效或效果微弱。即在无牛血清培养体系中, TNF-Q和IL-1β不能将iDC诱导成为mDC, 或仅能诱导一小部分iDC成为mDC。
后来的研究表明, 用单核细胞条件培养基(Monocyte-conditioned medium, MCM) ,即单核细胞在包被有免疫球蛋白的细菌平皿上无牛血清培养24小时后得到的培养上清,可在无牛血清培养体系中诱导DC的完全成熟。因此认为, 1%人自体血浆+MCM可能成为临床上获得成熟DC的标准方法。
但每次制备的MCM的一致性很难保证, 导致每批MCM必须经过测试后才能确定最适用量, 这给临床应用带来阻力和不稳定性。所以, 人们一直想寻找到能够替代MCM的化学成分明确的成熟诱导组合。
1997年, 德国美因茨大学(Mainz University) 的Jon ule it等取得了突破性进展, 他们发现TNF-Q, IL-1β和IL-6三种细胞因子的组合可完全替代MCM, 在无牛血清培养体系中能够将iDC诱导成完全成熟的DC。
4.PGE 2与DC:
德国美因茨大学的Jon ule it在证明TNF-α, IL-1β和IL-6三种促炎症因子的组合可完全替代MCM, 在无牛血清培养体系中能够将iDC完全诱导成熟的同时, 也发现另一种炎症介质, 即PGE 2可进一步提高DC的产量、成熟度、迁移能力和免疫激活能力。也就是说在TNF-u, IL-1β和IL-6之外添加PGE 2可获得更为成熟和高效的DC, 这样会提高临床上DC的治疗效果。
PGE 2常被加入DC成熟诱导组合中最重要的原因是其可提高成熟DC的迁移能力,这样可使DC更容易到达淋巴结,从而引起免疫反应、治疗肿瘤但我们也应该注意以下几点:
1) PGE 2不能添加到DC诱导分化的Step 1中, 如加入, DC的分化将会被抑制。
2) 我们知道, 能诱导机体产生Thl反应的DC(很多文献中称为DC 1) 有助于多种肿瘤,如黑色瘤和恶性胶质瘤等的治疗。
实验研究表明, 在成熟诱导因子(TNF-α/IL-1β) 中加入PGE 2倾向于将iDC诱导成为成熟的DC 2, 而非DCI, 该DC会诱导产生Th 2反应。所以很多人试图寻找能够诱导DC 1的最佳成熟诱导组合, 如TNF-α/IL-1β/IFN-0/IFN-y/poly-I:C,TNF-α/IL-1B/IFN-y/PGE 2(低浓度) /R 848(TLR 7/8激动剂) 和IFN-y/LPS序贯组合等,但这些新组合都未得到临床上的充分验证,也就没有真正用于临床级别DC的制备。
3) 其实, 各家的研究结果不尽相同。比如, TNF-0/IL-1B/IL-6/PGE 2组合的创立者--德国美因茨大学的Jon ule it在研究时就发现, 添加PGE 2诱导成熟的DC在刺激T细胞时可显著提高其分泌的IFN-y产量, 而对IL-4和IL-10的分泌无影响,提示添加PGE 2诱导成熟的DC具有诱导Thl反应的倾向。
总之,培养体系中是否加入小牛血清,以及所使用的无血清培养基种类不同等诸多因素都可能导致添加PGE 2诱导成熟的DC在性质上的差异, 因此临床上制备DC时最好能够做充分的前期研究,然后确定用于治疗某种肿瘤最好的制备方法。
更多详细信息或相关产品,请联系Peproteh中国授权代理--欣博盛生物
全国服务热线: 4006-800-892 邮箱: market@neobioscience.com
深圳: 0755-26755892 北京: 010-88594029 上海: 021-34613729
广州: 020-87615159 香港: 852-69410778
代理品牌网站: www.neobioscience.com
自主品牌网站: www.neobioscience.net