Mirus公司最新推出的适用于临床前研究和早期临床实验中大规模生产重组腺相关病毒和慢病毒转染试剂TransIT-VirusGEN®SELECT Transfection Reagent面世了,TransIT-VirusGEN®系列转染试剂旨在提高载体DNA转染到悬浮和贴壁HEK293细胞的转染效率,并增加重组腺相关病毒和慢病毒的产量。并可提供BSE TSE Statement 和质量控制的相关文件,以简化辅助材料的资质认证过程,节省时间和成本,确保从研发到大规模生产的无缝衔接,成为临床前研究和早期临床实验中大规模生产重组腺相关病毒/慢病毒的理想工具。
产品特点:
高效转染DNA,适用于临床前研究和早期临床实验中重组腺相关病毒
和慢病毒的大规模生产;
质控严格,包括产品性能、批次重复性、无菌性、内毒素及支原体含
量测试;
灵活性好,兼容不同的病毒生产平台并且允许重复过滤;
无动物源成分,保证全合成制剂成分清晰。
验证实例:
 | 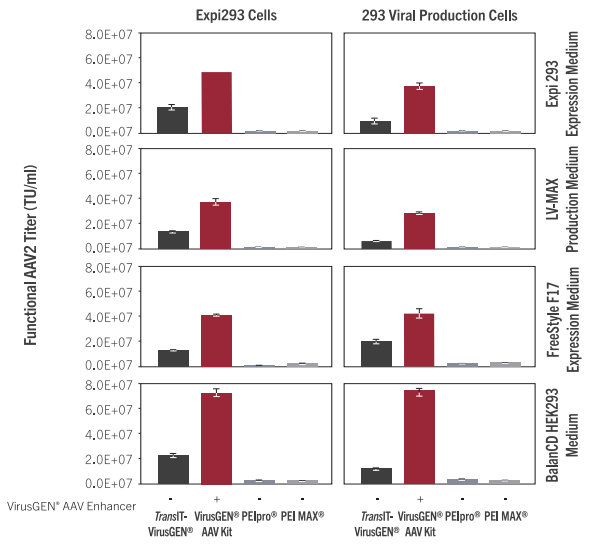 |
| 图1. TransIT-VirusGEN® Reagent和 VirusGEN® AAV Transfection Kit能产生更高的AAV滴度。 A.在Expi293 Expression Media(Thermo Fisher)中生长的Expi293F细胞(Thermo Fisher)使用TransIT-VirusGEN®转染试剂(1.5:1 reagent-to-DNA ratio (vol:wt), Mirus Bio LLC),VirusGEN®AAV转染试剂盒(Mirus Bio LLC),PEIpro (1:1,Polyplus)和FectoVIR®-AAV (1:1, Polyplus)的瞬时 转 染 来 产 生 重 组 AAV2。AAV2是 通 过 转 染 pAAV-hrGFP、pAAV-RC和 pAAV-Helper质 粒(1:1:1的DNA比例,每瓶2 μg/ml-2 mg,Agilent Technologies)产生的。1L的2×106细胞/ml密度在2.8L 的Thomson shake flask中转染。在转染后72小时使用化学裂解收获AAV2。通过转导HT1080细胞来测定功能性滴度,并在转导后48小时使用Guava®easyCyte 5HT流式细胞仪测量绿色荧光蛋白的表达。用少于20% GFP阳性细胞的病毒稀释液测量AAV功能滴度。基因组拷贝通过使用引物和靶向CMV启动子的 探针的ddPCR测 定 。B. 使 用 AAV2 Titration ELISA Kit(Progen)测定总组装衣壳,通过将基因组拷贝数除以每种条件下的总组装衣壳来确定GC/capsid ratio。误差线代表duplicate flasks的范围。 | 图2. 在不同的悬浮细胞类型和培养基配方中TransIT-VirusGEN® Reagen和VirusGEN®AAV Transfection Kit在AAV生产中的表现优于基于PEI的试剂。(A) Expi293F细胞(ThermoFisher)或(B)病毒生产细胞(ThermoFisher)在转染前适应或生长在Expi293培养基 (Thermofisher)、LV-MAX (Thermofisher)、FreeStyle™ F17 (ThermoFisher)或BalanCD HEK293 (Irvine Scientific)培养基。使用TransIT-VirusGEN®转染试剂(2:1reagent-to-DNA ratio (vol:wt)(体 积 :重 量 ), Mirus Bio LLC),VirusGEN® AAV Transfection Kit(Mirus Bio LLC)的 AAV生 产 与 PEIpro (1:1reagent-to-DNA ratio(vol:wt),Polyplus)和PEI MAX (2:1reagent-to-DNA ratio (vol:wt),Polysciences)进行比较。AAV2是通过转染pAAV-hrGFP、pAAV-RC和pAAV-Helper质粒(1:1:1 DNA比例,1.5μg/ml = 3μg/孔,Agilent Technologies)产生的。细胞以200万细胞/ml的细胞密度转染。收获的病毒用于转导HT1080细胞,并在转导后48小时使用Guava® easyCyte™5HT流式细胞仪测量绿色荧光蛋白的表达。用少于20% GFP阳性细胞的病毒稀释液测量AAV功能滴度。误差线代表重复孔的范围。 |
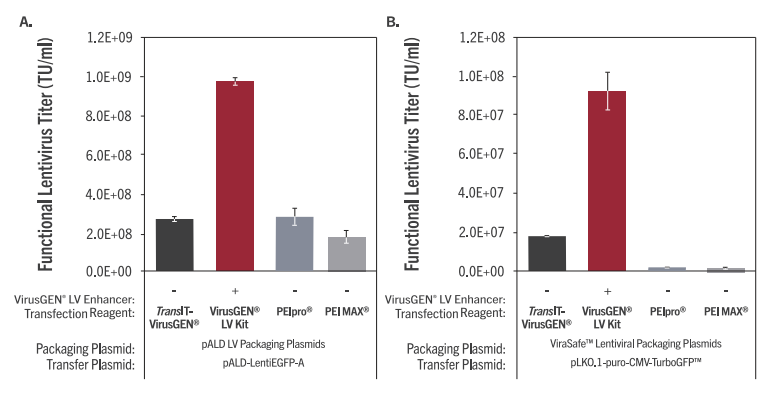 | 图3. TransIT-VirusGEN® Reagent和VirusGEN® LV Transfection Kit在多种慢病毒包装系统方面优于基于PEI的试剂。使用TransIT-VirusGEN®转染试剂 +/-将 VirusGEN® LV Enhancer与 PEIpro (2:12:1 reagent-to-DNA ratio,Polyplus)和PEI MAX (4:12:1 reagent-to-DNA ratio,Polysciences)进行比较。慢病毒是通过用两种不同的LV载体混合物(1μg/ml,2μg/ml)转染在Expi293表达培养基(Thermo Fisher)中生长的Expi293细胞而产生的,包括:(A)第三代载体pALD-LentiEGFP-A转移载体和pALD-VSV-G-A、pALDRev-A、pALD-GagPol-A包 装 载 体 (3:0.5:0.5:2 DNA比 例 , Aldevron)或(B)第 三 代 载 体 pLKO.1-puro-CMV-TurboGFP™ transfer vector(MilliporeSigma) 和 ViraSafe™ Pantropic Packaging mix (pRSV-Rev,pCMV-VSV-G, pCgpV, CellBio Labs) 以 3:0.5:0.5:2 DNA比例转染。在转染后18小时,将VirusGEN® LV Enhancer加入到TransIT-VirusGEN®中。含病毒的上清液用于转导293T/17细胞,并在转导后72小时使用Guava®easyCyte™ 5HT流式细胞仪测量绿色荧光蛋白的表达。慢病毒功能滴度是从含有少于20%GFP阳性细胞的病毒稀释液中测定的。误差线代表重复孔的范围。 |
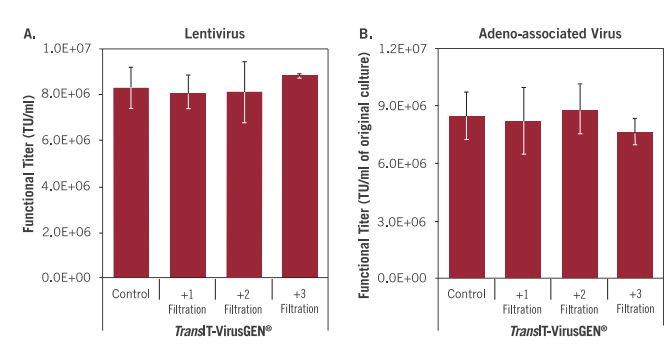 |  |
| 图4. TransIT-VirusGEN® Reagent和VirusGEN® LV Transfection Kit可与多种细胞系和培养基配方兼容,用于在悬浮293细胞中生产慢病毒。在LV-MAX生产培养基(ThermoFisher)中生长的病毒生产细胞(293-VP)、在Expi293表达培养基(ThermoFisher)中生长的Expi293细胞或在FreeStyle™F17 (ThermoFisher)中生长的FreeStyle™ 293-F细胞在转染前以4×10^6细胞/ml接种(2ml/未处理的6孔 板 )。使用 TransIT-VirusGEN 转 染 试 剂 +/- VirusGEN LV Enhancer(Mirus Bio,3:1 reagent-to-DNA ratio(wt:vol))生产慢病毒。通过以3:0.5:0.5:2的DNA比例(Aldevron,25μg/瓶(1μg/ml最终浓度 ))转染第三代载体 ALD-LentiEGFP-A转移载体和 pALD-VSV-G-A、pALD-RevA、pALD-GagPol-A包装载体来生产慢病毒。转染后18小时加入 VirusGEN® LV Enhancer。在转导 293T/17细胞后,测量含病毒上清液的功能滴度,并在转导后72小时,使用Guava easyCyte™5HT流式细胞仪测量绿色荧光蛋白的表达。慢病毒功能滴度是从含有少于 20% GFP阳性细胞的病毒稀释液中测定的。误差条代表三个孔的标准偏差。 | 图5. TransIT-VirusGEN转染试剂可以多次过滤且对试剂性能没有影响。 (A)使用在FreeStyle™ F17培养基中生长的悬浮FreeStyle™ 293-F细胞生产慢病毒,并用第三代载体pLKO.1-puro-CMV-TurboGFP转移载体(Sigma)和ViraSafe™ Pantropic Packaging mix (pRSV-Rev, pCMV-VSV-G, pCgpV, Cell Bio Labs)以 3:0.5:0.5:2的DNA比例转染,总质粒1ug/ml,使用TransIT-VirusGEN转染试剂(3:1,体积:重量),TransIT-VirusGEN® Transfection Reagent (3:1, vol:wt)通 过 0.22 um polyethersulfone(PES)过滤装置(Millipore Sigma)过滤指定次数。使用通过含病毒的上清液转导 ® 293T/17细胞,并在转导后72小时使用Guava easyCyte™ 5HT流式细胞仪测量绿色荧光蛋白的表达。 (B)AAV2是通过在FreeStyle™ F17培养基中生长的悬浮FreeStyle™ 293-F细胞产生的,使用TransIT-VirusGEN® Transfection Reagent (2:1, vol:wt)转 染 pAAVhrGFP、pAAV-RC和 pAAV-Helper质 粒 (1:1:1DNA ratio,1.5u g/ml,AgilentT ® echnologies)。收获的病毒用于转导HT1080细胞,并在转导后48小时使用Guava easyCyte™ 5HT Flow Cytometer.流式细胞仪测量绿色荧光蛋白的表达。对于慢病毒和AAV病毒,功能滴度都是从含有少于20% GFP阳性细胞的病毒稀释液中测定的。误差条代表三个孔的标准偏差。 |
验证实例
用途
| 科研 | 临床前和早期临床实验 | 后期临床试验和商业生产 |
| 名称 | TransIT-VirusGEN® 
| TransIT-VirusGEN® SELECT 
| TransIT-VirusGEN® GMP 
|
成分
| 相同的TransIT-VirusGEN® 试剂配方可随时使用,化学成分明确,不含动物源,含有77.5%乙醇 |
是否提供 LV 和 AAV Enhancer Kits | 提供 | 即将推出 | 提供
|
| 货号 | 名称 | 货号 | 名称 |
| MIR 6750 | VirusGEN® AAV Transfection Kit | MIR 6815-GMP | VirusGEN® GMP AAV Transfection Kit |
| MIR 6760 | VirusGEN® LV Transfection Kit | MIR 6825-GMP | VirusGEN® GMP LV Transfection Kit |
| 质检标准 | Functional AAV titer assay | Functional AAV titer assay Formulation Identity Appearance Sterility per USP<71> Bacterial endotoxin per USP<85> Mycoplasma per USP<63> | Validated Formulation Identity Assay Appearance Sterility per USP<71> Bacterial endotoxin per USP<85> Mycoplasma per USP<63> |
货号与规格 | MIR 6703 MIR 6704 MIR 6700 MIR 6705 MIR 6706 MIR 6720 | 0.3 ml vial 0.75 ml vial 1.5 ml vial 5 x 1.5 ml vials 10 x 1.5 ml vials 30ml | MIR 6730 MIR 6735 30ml bottle (for 10 L of cell culture) 150ml bottle (for 50 L of cell culture) | MIR 6845-GMP | 150 ml bottle (for 50 L of cell culture) |
| 提供文件材料 | Certificate of Analysis Certificate of Origin | Certificate of Analysis Certificate of Origin TSE/BSE Statement | Certificate of Analysis
Certificate of Origin with TSE/BSE
Statement
DMF Available in 2022 with
Quality Agreement |
更多详细信息,请联系Mirusbio国内代理商-欣博盛生物
全国服务热线: 4006-800-892 邮箱: market@neobioscience.com
深圳: 0755-26755892 北京: 010-88594029
上海: 021-34613729 广州: 020-87615159
代理品牌网站: www.neobioscience.com
自主品牌网站: www.neobioscience.net