
安捷伦(Prozyme) 2-AB染料高通量糖型分析平台
摘要
本应用简报介绍由生物治疗性糖蛋白进行N-糖链前处理,用于释放糖链分析。N-糖链分析对治疗性蛋白质的开发和生产十分重要,因为糖链组成可直接影响产品的安全性和有效性。本方案介绍Agilent AdvanceBio Gly-X 2-AB Express试剂盒在使用PNGase F释放糖链、通过还原胺化进行标记、在两小时内(无需一整天或更长时间)净化游离染料方面的应用。所用标记是2-氨基苯甲酰胺 (2-AB),因其完善的用途以及与大量历史糖链分析数据的一致性而得到广泛认可。
前言
糖基化是许多生物治疗蛋白质的共同特 征,可以影响药代动力学、药效学和免疫 原性1,通常作为关键质量属性2。因此,必须在整个开发和生产过程中仔细表征和监测生物治疗性糖基化。通常在分析之前对糖链进行衍生化,因为它们本身不吸收紫外线或荧光,且难以电 离得到MS检测。广泛使用的荧光标记屈指可数,包括 2-AB 和 2-AA,它们通过还原胺化修饰释放的N-糖链3。最近推出了具有更高的荧光和MS灵敏度的标记4。
早期的2-AB标记方案通常较长,需要经历多个长时间的温育期。这不仅耗费了用户的大量时间,还使用户无法快速获得结果并根据这些结果做出决策。如果不经过长时间温育,去糖基化通常不完全,因此常需要过夜消解。通过还原胺化固定2-AB标记是标记前糖链干燥的前一步,标记反应通常需要温育数小时。此外,液相色谱分析前用于去除过量2-AB试剂的旧款净化柱操作繁琐,不适用于高通量或自动化工作流程。
Agilent AdvanceBio Gly-X 2-AB Express 试剂盒的方案包括N-糖链样品前处理的所有高级步骤:变性、去糖基化、标记和 样品净化,如图 1 所示。
实验部分
材料
HPLC级乙腈购自Sigma-Aldrich。水经由Milli-Q A10水纯化系统 (Millipore) 纯化。
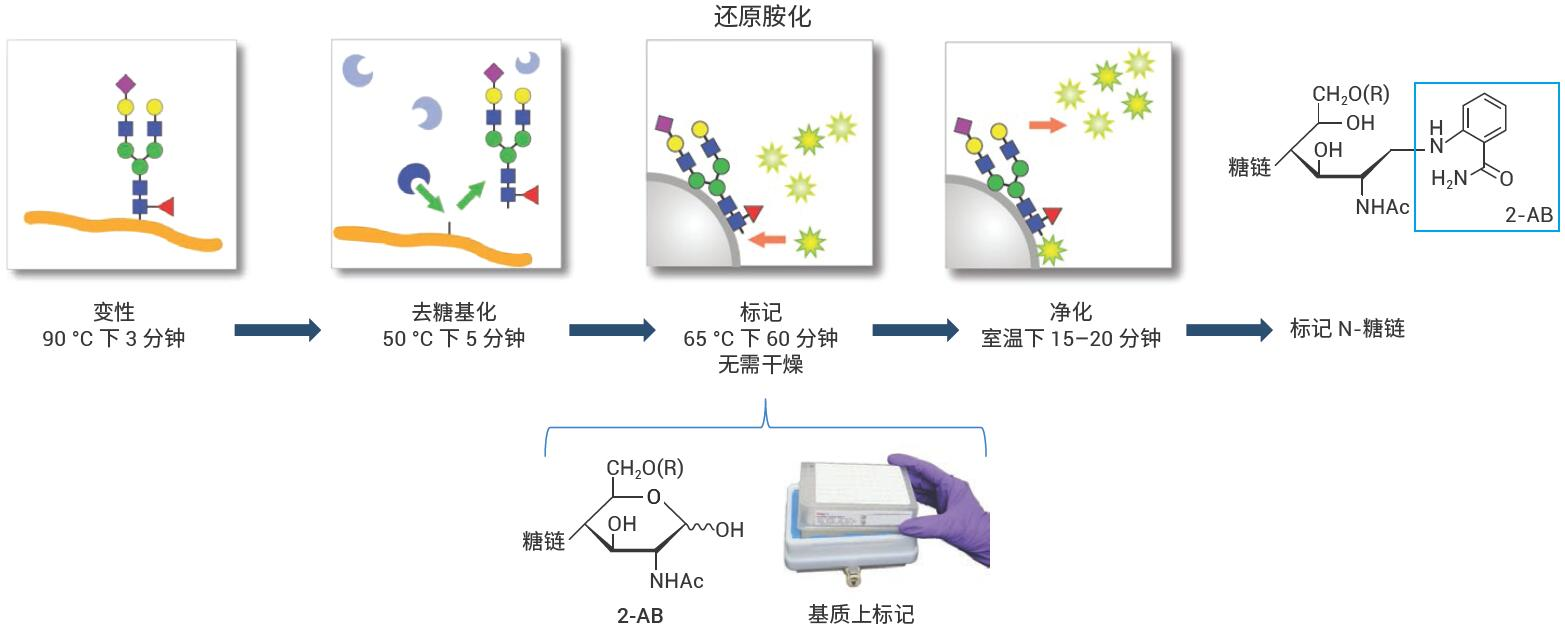
图 1. 用于释放和标记 N-糖链的AdvanceBio Gly-X 2-AB Express工作流程
N-糖链样品前处理
使用AdvanceBio Gly-X 2-AB Express试剂盒(部件号 GX96-2AB)进行标记N-糖链 的样品前处理。图2展示了试剂盒组成。 AdvanceBio Gly-X N-糖链样品前处理包含一系列酶和化学步骤,从目标蛋白质的变性开始(图 3)。加入变性试剂,将样品在 90 °C 下温育3分钟。蛋白质的有效去折叠有助于PNGase F酶仅在5分钟内对N-糖链实现高效的溶液中酶切4。PNGase F对N-连接糖链具有特异性,因此仅有N-糖链从蛋白质中去除(图 4),而任何O-连接糖链和非酶糖基化仍连接在蛋白质上。
标记和净化步骤在HILIC型固相载体 上进行。在上样到固定相之前,将释放N-糖链在溶液中转化为 -OH 形式,然后经 2-AB标记试剂标记,并将固定相在65 °C下温育1小时(图 5)。标记完成后,通过一系列乙腈清洗冲洗掉过量试 剂。然后用水洗脱标记 N-糖链(图 6)。 基质上标记省去了在2-AB标记之前干燥释放糖链的步骤。

图2.AdvanceBio Gly-X 2-AB Express N-糖链样品前处理试剂盒组成
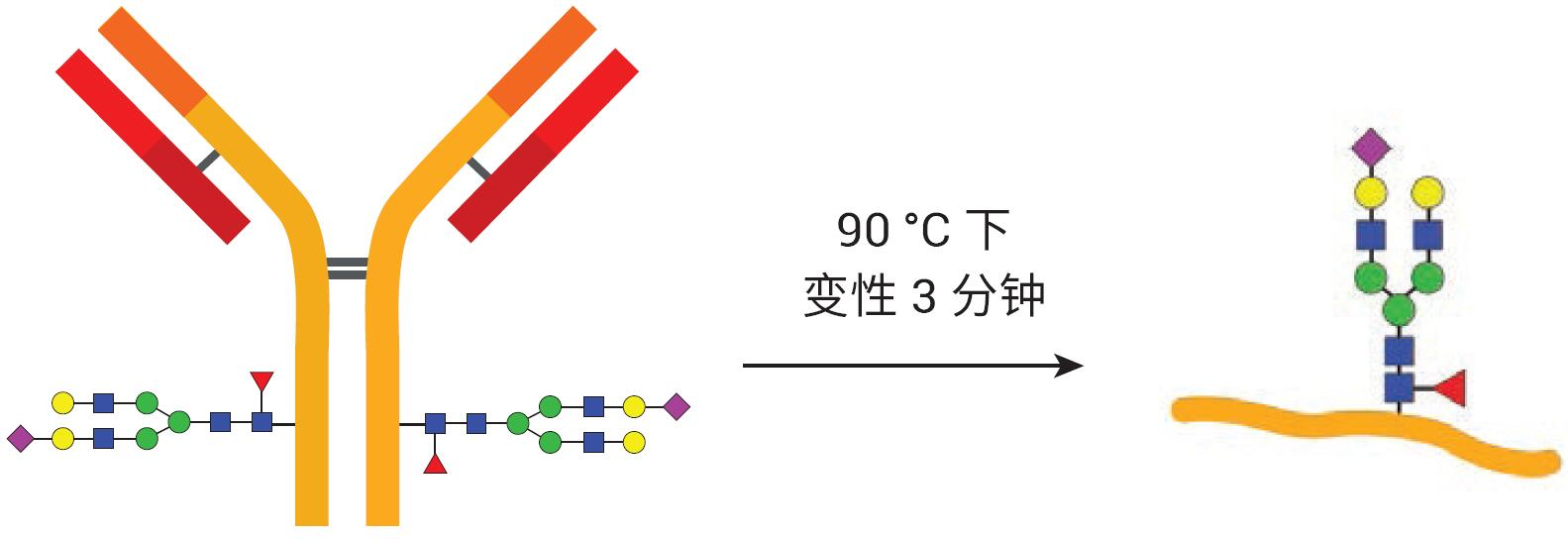
图3. 首先使样品蛋白质变性,以便在后续步骤中有效去糖基化
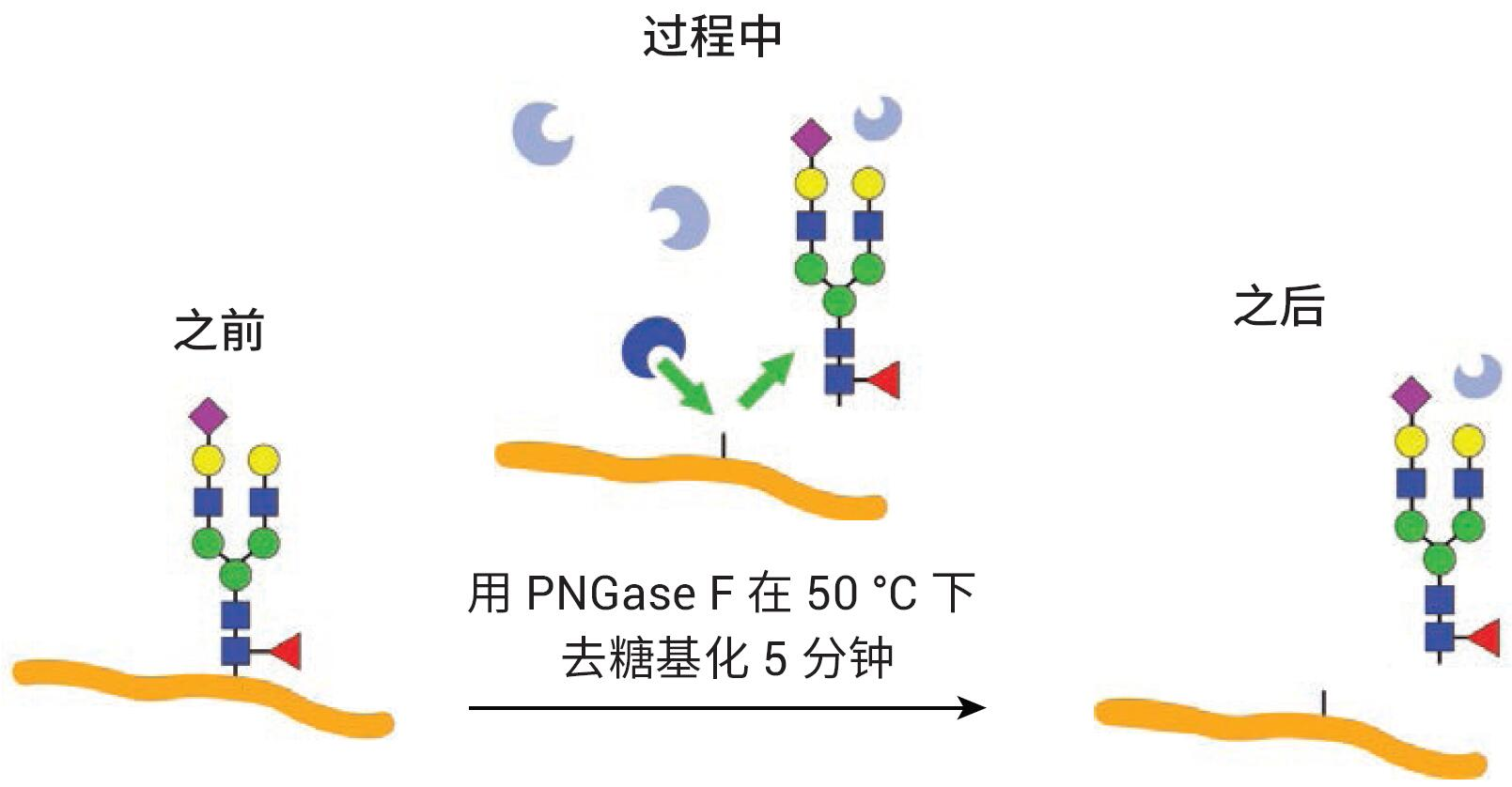
图4. 采用 PNGase F从蛋白质上快速剪切N-糖链

图5. 将样品上样到真空净化板上的HILIC型固定相担体上。然后将2-AB标记试剂加入固定相担体中,温育1小时。无需后续干燥步骤
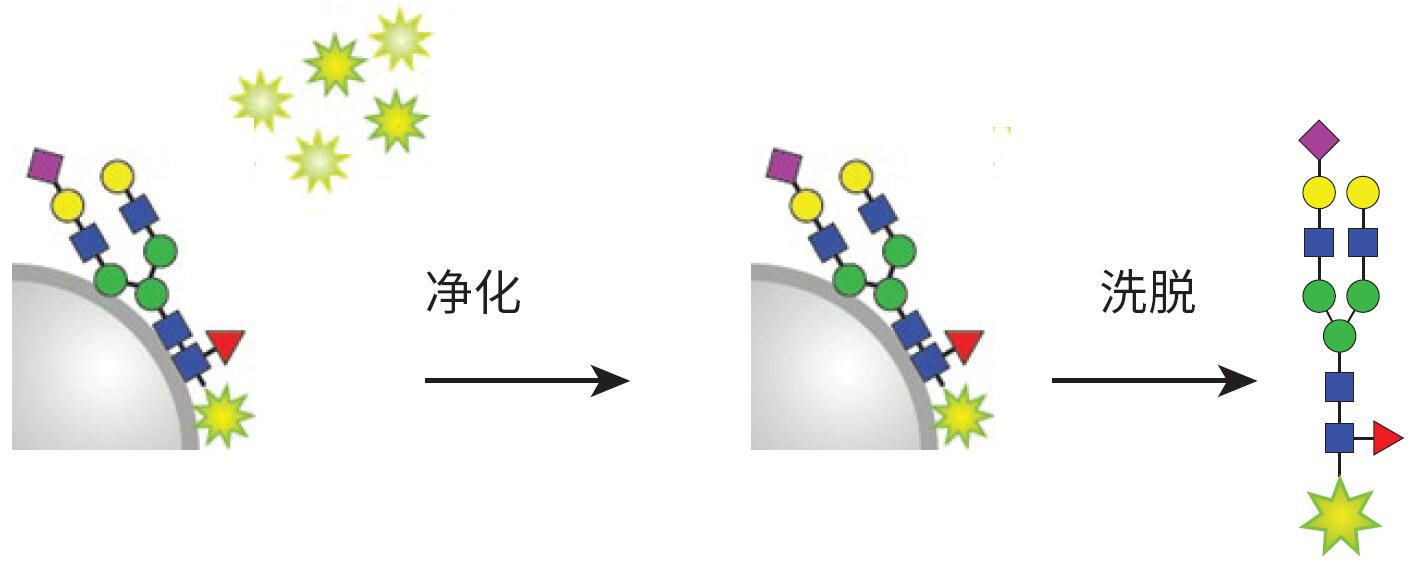
图6. 冲掉过量标记试剂,从固体固定相中洗脱标记糖链
仪器
使用安捷伦液相色谱系统中的Agilent AdvanceBio糖谱分析色谱柱分析样品,系统包括以下模块:
• Agilent 1290 Infinity II 高速泵(G7120A)
• Agilent Infinity Multisampler(G7167B)
• Agilent 1290 Infinity II 高容量柱温箱(G7116B)
• Agilent 1260 Infinity 荧光检测器(G1321B)
软件
• Agilent MassHunter 采集软件
• Agilent MassHunter 定性分析软件
结果与讨论
采用 LC/FLD 分析 MabThera 和 Enbrel 2-AB N-糖链样品。代表性色谱图如图 7 所示。MabThera 具有更简单的糖基化模 式,Enbrel 则表现出更高的唾液酸化糖链水平。样品前处理的重现性十分重要,因 此可以比较不同生产批次的样品。待测量 的变异性需要是真正来源于样品的差异, 而不是样品处理或分析造成的人为因素。
表 1. 液相色谱方法
| 参数 | 值 |
| 色谱柱 | Agilent AdvanceBio 糖谱分析色谱柱,2.1×150mm,1.8µm(部件号 859700-913) |
| 柱温 | 40 °C |
| 流动相 | A) 50 mmol/L 甲酸铵,pH4.5;
B) 乙腈 |
| 流速 | 0.5 mL/min |
| 梯度程序 | 时间 (min) %B 流速 (mL/min) |
0.0 82 0.4
|
2.0 82 0.4
|
| 2.5 77 0.4 |
| 48.0 62 0.4 |
| 49.0 40 0.4 |
| 51.5 40 0.4 |
| 52.0 82 0.4 |
| 54.0 82 0.6 |
| 58.0 82 0.6 |
| 58.5 82 0.4 |
| 进样量 | 1µL(相当于0.4µg 蛋白质中的糖链) |
| 检测器 | Agilent 1290 Infinity II FLD
|
| 激发波长260nm |
| 发射波长430nm |
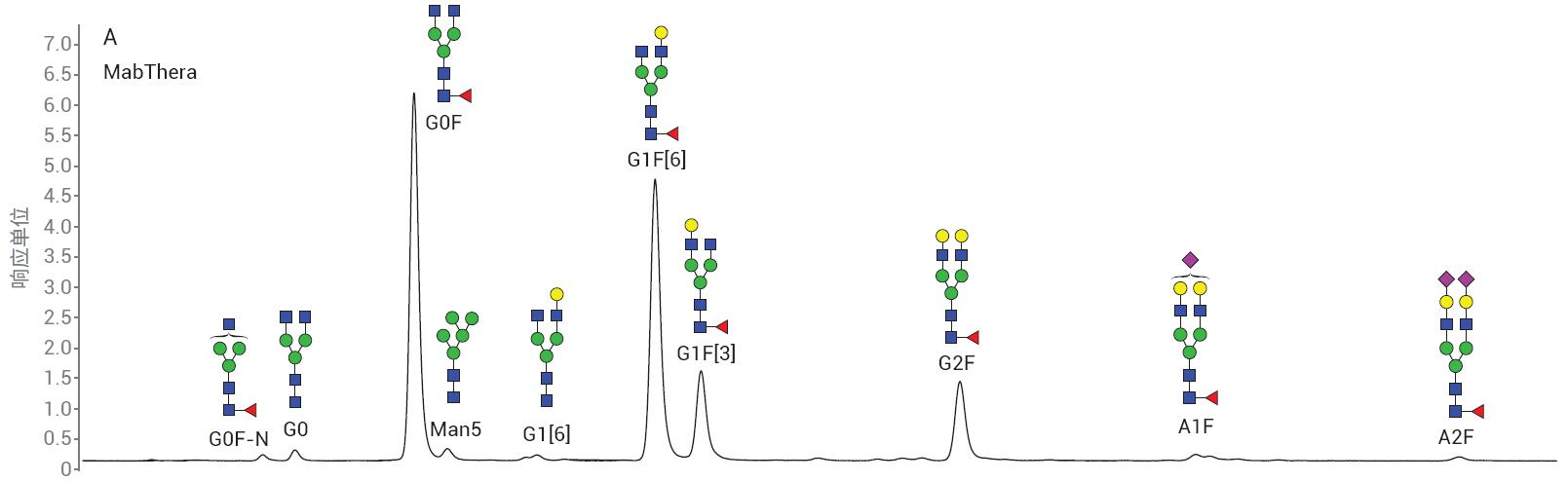
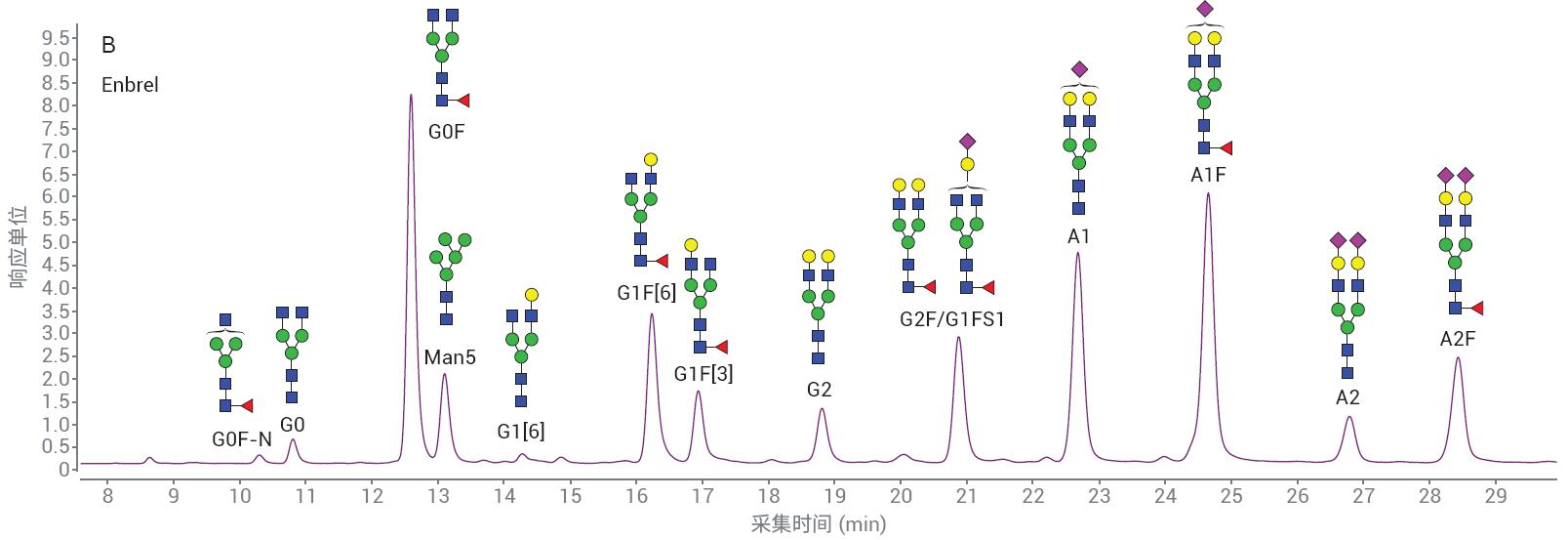
图7. 显示从A) MabThera和B) Enbrel分离2-AB标记的N-糖链的代表性色谱图
表2 显示了MabThera的三份样品中检出的主要N-糖链种类的相对峰面积百分比。表中列出了平均百分比峰面积以及标准偏差和相对标准偏差 (%CV)。除了丰度最低的糖链外,样品前处理之间的差异都很小。检测限附近的精度较难维持,因此预计这些峰的差异会更大。
如果任何研究人员要更改样品前处理方法,获得的数据必须与原方法等同,或在某种程度上优于原方法的结果。虽然也能用其他标记化学品,但继续使用2-AB的主要因素是能够将结果与使用其 他2-AB标记方案获得的旧数据进行比 较。图8显示了Enbrel的三份重复样品中检出的N-糖链的相对峰面积百分比。 使用AdvanceBio Gly-X 2-AB Express 和 ProZyme GlykoPrep 2-AB(ProZyme提供的前一代2-AB样品前处理标记物)进行样品前处理,多次前处理之间的相对丰度相差无几。
表2. MabThera 三份样品中主要N-糖链种类的相对峰面积百分比
| 糖链 | RT | 相对峰面积百分比 |
| 1 | 2 | 3 | 均值 | 标准偏差 | %CV |
| G0F-N | 10.32 | 0.56 | 0.57 | 0.57 | 0.57 | 0.01 | 1.02 |
| G0 | 10.81 | 1.09 | 1.01 | 0.98 | 1.03 | 0.06 | 5.54 |
| G0F | 12.62 | 39.85 | 39.31 | 39.33 | 39.5 | 0.31 | 0.78 |
| Man5 | 13.12 | 0.74 | 0.62 | 0.69 | 0.68 | 0.06 | 8.82 |
| G1[6] | 14.47 | 0.66 | 0.6 | 0.62 | 0.63 | 0.03 | 4.88 |
| G1F[6] | 16.27 | 34.65 | 34.81 | 34.67 | 34.71 | 0.09 | 0.25 |
| G1F[3] | 16.96 | 10.65 | 10.47 | 10.6 | 10.57 | 0.09 | 0.88 |
| G2F | 20.89 | 10.15 | 10.78 | 10.83 | 10.59 | 0.38 | 3.58 |
| A1F | 24.45 | 1.13 | 1.26 | 1.17 | 1.19 | 0.07 | 5.61 |
| A2F | 28.44 | 0.52 | 0.57 | 0.54 | 0.54 | 0.03 | 4.63 |
结论
采用Agilent AdvanceBio Gly-X 2-AB Express可在两小时内完成完全的N-糖链样品前处理,而旧方法则需要耗费一整 天,包括过夜温育和标记前干燥在内。各 种糖蛋白生成的数据具有高度重现性,并 与采用旧款2-AB样品前处理方法获得的数据一致。
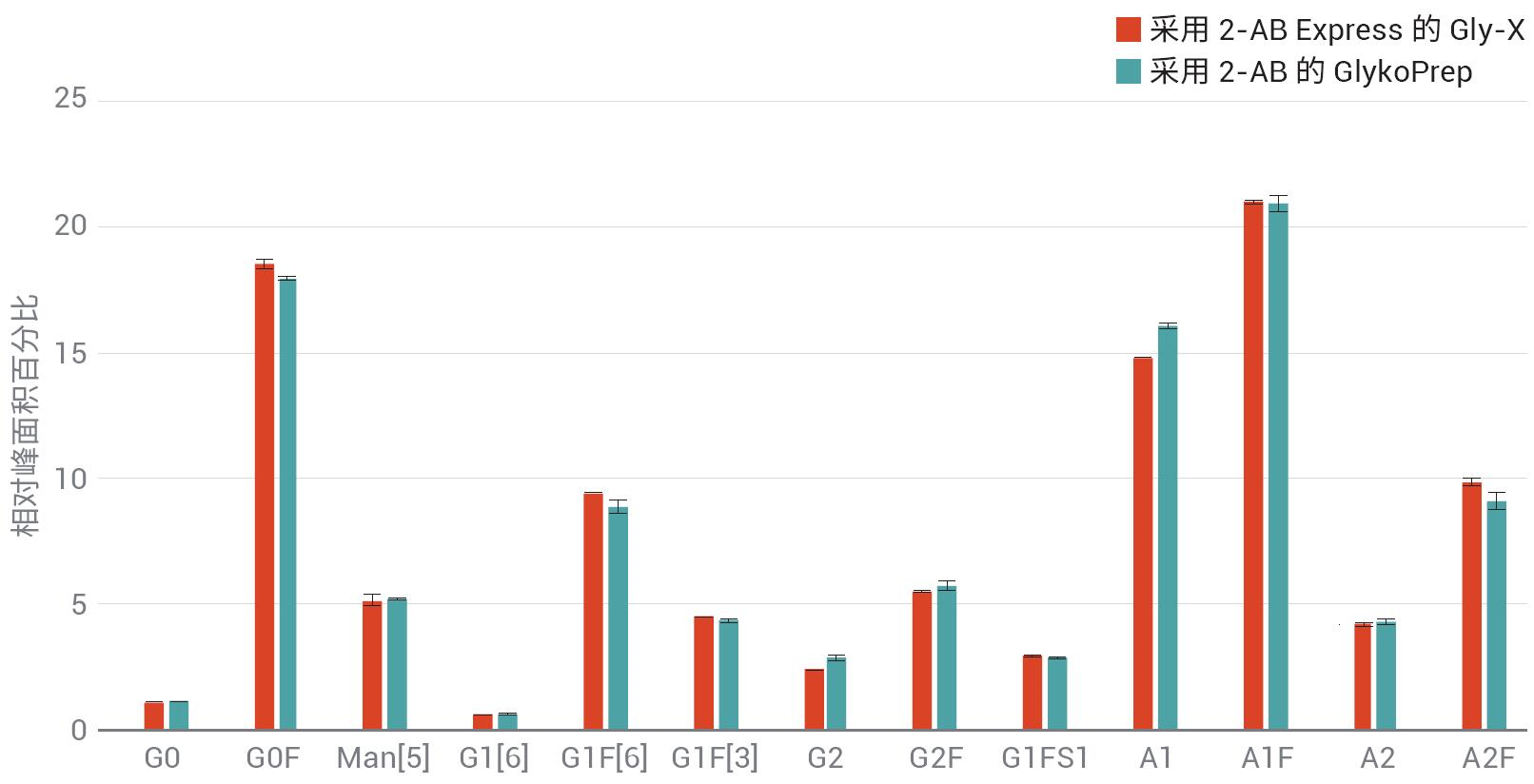
图8. 采用AdvanceBio Gly-X 2-AB Express试剂盒得到的样品生成的数据与采用旧方法(如 ProZyme GlykoPrep 2-AB)得到的样品数据相差无几,此处展示的是来自Enbrel的N-糖链。所有数据均n=3
参考文献
1. Liu, L. Antibody Glycosylation and its Impact on the Pharmacokinetics and Pharmacodynamics of Monoclonal Antibodies and Fc-Fusion Proteins. J. Pharm. Sci. 2015, 104(6), 1866–1884
2. Reusch, D.; Tejada, M. L. Fc Glycans of Therapeutic Antibodies as Critical Quality Attributes. Glycobiology 2015, 25(12), 1325–1334
3. Ruhaak, L. R.; et al. Glycan Labeling Strategies and Their Use in Identification and Quantification. Anal. Bioanal. Chem. 2010, 397(8), 3457–3481
4. Kimzey, M.; et al. Development of a 5-Minute Deglycosylation Method for High Throughput N-Glycan Analysis by Mass Spectrometry. ProZyme Technical Note, Bulletin 4001, Rev E
全国服务热线: 4006-800-892 邮箱: market@neobioscience.com
广州:18024516375 香港: 852-69410778
自主品牌网站: www.neobioscience.net